





《高中化学必修二化学反应总结PPT课件》是由用户上传到老师板报网,本为文库资料,大小为681.5 KB,总共有20页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 20页
- 681.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
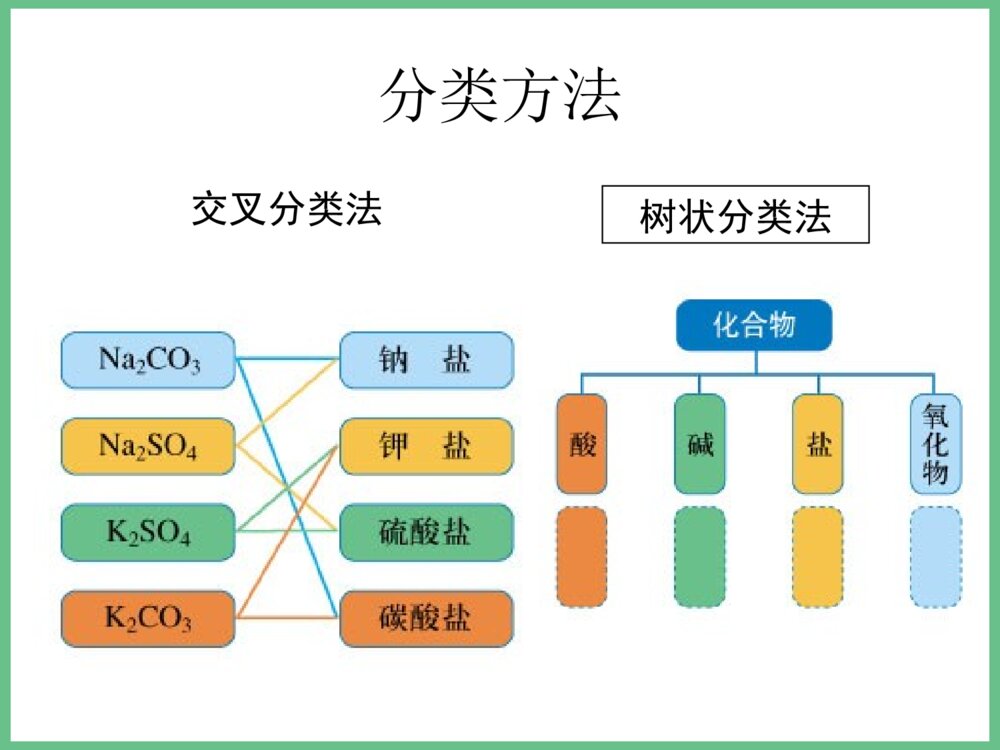
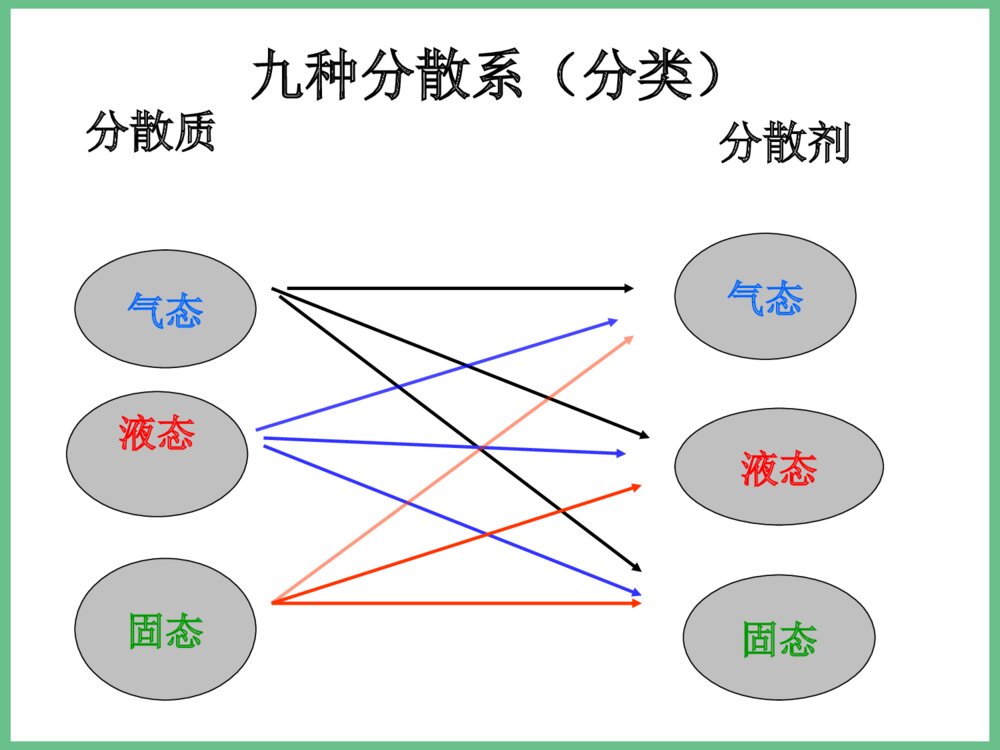
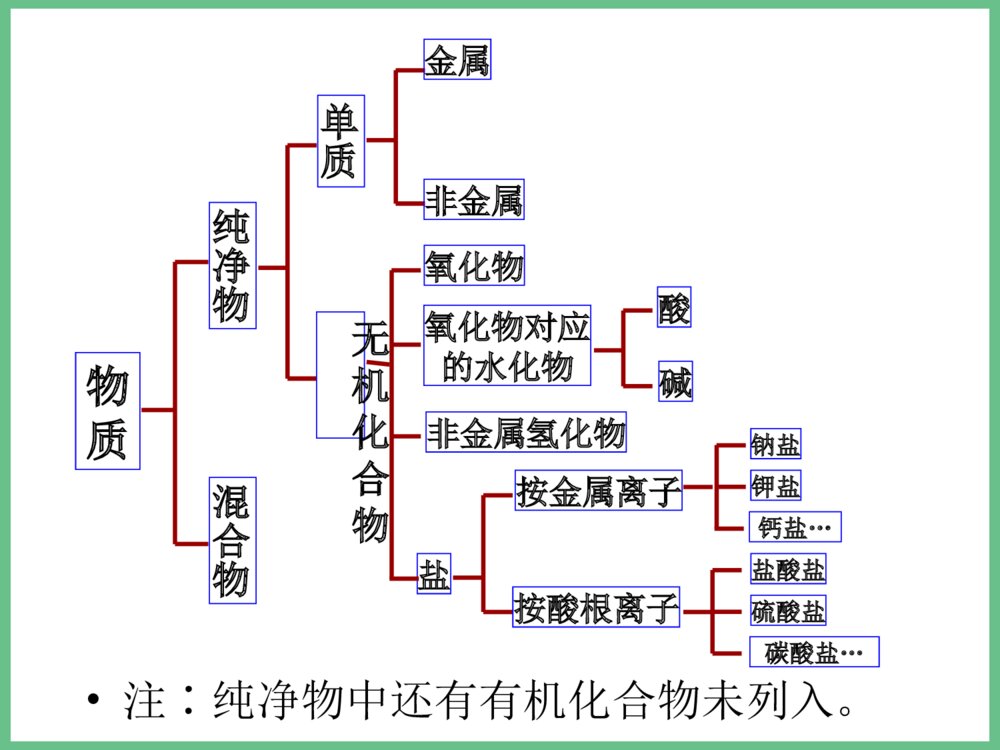
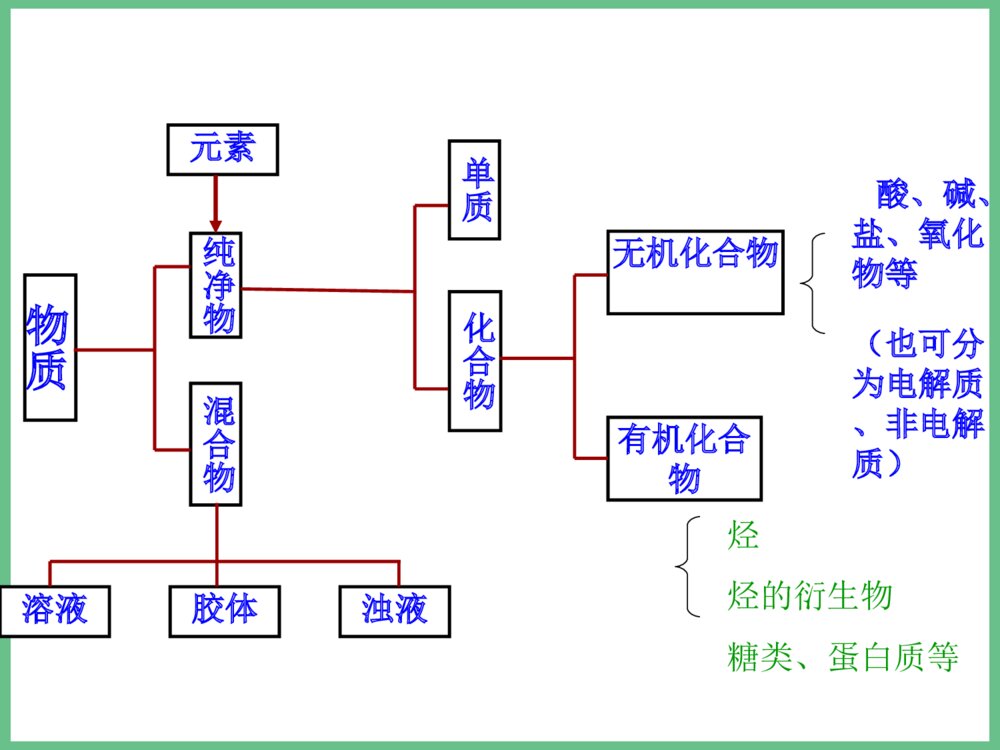
必修1之专题一小结•1、化学反应的四大•化合反应∶A+B=AB•基本反应类型分解反应∶AB=A+B•置换反应∶AB+C=AC+B•复分解反应∶AB+CD=AD+CB•△各种反应类型的关系∶所有的置换反应都是氧化还原反应,化合和分解反应有些也是氧化还原反应;复分解反应一般都是离子反应,有些置换反应也是离子反应。•△物质可以从多角度分类∶(见下页)交叉分类法树状分类法分类方法气态液态固态气态液态固态分散质分散剂九种分散系(分类)•注∶纯净物中还有有机化合物未列入。物质纯净物混合物单质金属非金属氧化物氧化物对应的水化物非金属氢化物盐按金属离子按酸根离子酸碱钠盐钾盐钙盐…盐酸盐硫酸盐碳酸盐…无机化合物物质纯净物混合物单质化合物无机化合物有机化合物溶液胶体浊液元素酸、碱、盐、氧化物等(也可分为电解质、非电解质)烃烃的衍生物糖类、蛋白质等例析∶1.某加碘食盐包装袋上标有“忌高温蒸炒”,由此判断下列说法中正确的是( )•A.此食盐是纯净物;B.食盐中加入了碘单质;C.所加含碘物质受热易分解 ;D.加碘食盐难溶与水。2.下列化学反应属于置换反应的是( )• A.NaOH+HCl==NaCl+H2O•B.H2CO3==H2O+CO2•加热•C.H2+ CuO==Cu+H2O•点燃•D.2CO+O2==2CO2CC•例3、同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。•(1)生石灰属于哪种类别的物质?•(2)生石灰可做干燥剂的理由是什么?(用化学方程式表示)•(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。•(4)小纸袋中的物质能否长期持续地做干燥剂?为什么?•(5)在你所认识的化学物质中,还有哪些可以用作干燥剂?列举一例。•答案:(1)化合物、金属氧化物、固态物质等。•(2)CaO+H2O=Ca(OH)2•(3)与酸的反应:CaO+2HCl=CaCl2+H2O;与非金属氧化物反应:CaO+CO2=CaCO3•(4)不能,因为生石灰全部变为Ca(OH)2后,就不能持续起到干燥作用。•(5)浓硫酸、CaCl2、P2O5、碱石灰等•例4.美国和日本正在研究用亚硫酸钠(Na2SO3)吸收法作为治理二氧化硫污染的一种新方法。第一步是用亚硫酸钠溶液吸收二氧化硫生成亚硫酸氢钠;第二步是加热溶液,使之重新生成亚硫酸钠,同时得到含高浓度二氧化硫的副产品。试写出上述两步反应的化学方程式:•第一步:,• ;•第二步:• 。Na2SO3+SO2+H2O=2NaHSO3•2NaHSO3=Na2SO3+SO2↑+H2O继续专题一复习•2、物质的量(n)是计量原子、分子、离子等微观粒子的物理量。•摩尔(mol)是物质的量的单位。1mol任何粒子所含粒子数与0.012Kg12C中所含碳原子数相等。0.012Kg12C中所含碳原子数又叫阿伏加德罗常数(NA),其近似值为6.02×1023mol-1。•n(粒子的物质的量)=N(粒子的数目)/NA(阿伏加德罗常数)•由于粒子的物质的量与粒子的数目密切相关,所以在使用物质的量时必须指明具体粒子,具体粒子一般用化学式表示;如氢气的物质的量用n(H2)表示。物质的量联系着宏观可称量的物质和微观粒子,是联系宏观和微观的桥梁;物质的质量(m)→物质的量(n)→粒子数(N)。同时它又使质量守恒定律得到了升华,即化学反应前后各元素的物质的量保持不变。3、摩尔质量(M)是单位物质的量的粒子所具有的质量,也就是物质的质量除以其中粒子的物质的量,数值上等同于相对分子(原子)质量(即式量,或叫分子量、原子量),公式∶M=m/n。单位∶g/mol。计算物质的量时公式可移项为∶n=m/M•4、气体摩尔体积(Vm)是单位物质的量的气体分子所占有的体积,也就是气体体积(V)除以其中气体分子的物质的量,即VmV/n。在标准状况下(00C,101kPa)任何气体的气体摩尔体积都约22.4L/mol。5、物质的量浓度(c)是一种表示溶液组成的物理量,它反映了单位体积的溶液中所含溶质的物质的量的多少,也就是溶质的物质的量除以溶液的体积,即c=n/V;由于溶液是均一稳定的,无论将溶液分成几份,其物质的量浓度都保持不变。•6、有关物质的量方面的物理量的相互关系—是进行相关基本计算的重要依据∶•÷V(aq)×V(aq)÷M×M物质的质量(g)物质的量(mol)微粒数(个)×NA÷NASTP时气体体积V×Vm÷Vm以阿伏伽德罗常数个微粒所组成的微粒集体作标准,表示一定量的物质中含有多少个这样的微粒集体的物理量12g碳12C中所含碳原子的个数,大约为6.02×1023每摩尔物质的质量,单位为g/mol物质的量的单位,任何1mol物质中都含有阿伏伽德罗常数个微粒物质的量浓度c•适用于任何物质n=NNAn=Mm任何物质所含的微粒数任何物质的质量气体物质在STP时的体积n=VVm只适用于STP时的气体概括·整合CB=Vn溶质的物质的量浓度溶液的体积溶质的物质的量溶液的质量分数与物质的量浓度的换算关系及配制一定物质的量浓度溶液的步骤∶△CB=1000ml×ρg/cm3×%(B)Mg·mol-1×1L计算、准备仪器称量溶解转移定容摇匀装瓶贴签△基本步骤:算—称—溶—转—定—装•例1.现有硫酸铝和硫酸锌两种盐,试关于它们回答下列问题:•(1)0.5摩尔硫酸铝中所含铝离子的个数是多少?•(2)1摩尔硫酸铝的质量和硫酸铝的摩尔质量各是多少?•(3)在一定量硫酸铝和硫酸锌组成的混合物中,SO42-的物质的量共2mol,若铝离子和锌离子的物质的量之比为2 :3,则此混合物中硫酸锌的质量为多少?•解析:(1)物质的化学式可直观地显示出所含各离子的个数关系,可首先写出硫酸铝的化学式Al2(SO4)3,这样可一目了然地看出1摩尔Al2(SO4)3中含2摩尔Al3+,进而求出0.5摩尔硫酸铝中Al3+的物质的量和其个数:N(Al3+)=0.5mol×2×6.02×1023mol-1=6.02×1023.•(2)1摩尔硫酸铝的质量和硫酸铝的摩尔质量在数值上都等于硫酸铝的式量342,但单位不同,前者是质量单位为g,后者是物质的量单位为g/mol.•(3)由Al2(SO4)3和ZnSO4的化学式可知,当Al3+和Zn2+物质的量之比为23∶时,表明Al2(SO4)3和ZnSO4物质的量之比为13∶,Al2(SO4)3中的SO42-和ZnSO4中的SO42-之比为11∶,即混合物总共2摩尔SO42-中有1摩尔来自ZnSO4,故ZnSO4的物质的量为1摩尔,质量为160克。•练习∶1、用NA表示阿伏加德罗常数,下列说法正确的是( )•A.24克镁单质变为镁离子时,失去的电子数为NA B.18克水所含的电子数为NA;C.8克氦气所含分子数为NA ;D.3.2克氧气所含氧原子数为0.2NA•2.若1克水中含有m个氢原子,则阿伏加德罗常数用含m的代数式可表示为( )•A.m/9 B.9m C.2mD.18m•3.某盐的溶液中含有Na+、Mg2+、Cl-、SO42-四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl-为0.4mol,则SO42-物质的量为()•A.0.1molB.0.3molC.0.5molD.0.15molDBB•4、下列说法中不能成立的是()•A、1mol某种物质的质量称为该物质的摩尔质量;B. 1mol某种物质的体积称为该物质的摩尔体积;C. 固体和液体的摩尔体积各不相同;D.气体摩尔体积都约为22.4L/mol。•5、等物质的量的氢气和氦气在同温同压下具有相等的()•A.原子数B.体积C.质子数D.质量DB必修1之专题一暂时复习及练习到这里,还有物质的分离提纯及原子结构等知识我们下节课才说。回去完成第二十二次作业∶必修1总复习资料中的自我评估卷(83页之选择题)再见!



















